Лекція
Тема: Загальна характеристика Фосфору
1. Положення в періодичній системі. Будова атома.
2. Фізичні властивості, алотропія.
3. Хімічні властивості
4. Оксиди фосфору
5. Фосфати, фосфатні добрива
1. Положення в періодичній системі. Будова атома.
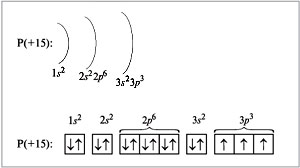
Характеристика Фосфору за періодичною таблицею:
- Р – фосфор;
- 15 - порядковий номер, 5- група, 3- період, головна підгрупа;
- 30 - відносна атомна маса, електрони – 15, протони -15, нейтрони-16.
P)2)8)5 1s22s2p63s2p3d
2. Фізичні властивості
Фосфор утворює кілька простих речовин, які розрізняють за властивостями:
а) білий;
б) червоний;
в) чорний.
Білий фосфор – м’яка, кристалічна речовина, безбарвна, прозора, нерозчинна у воді, у темряві світиться зеленувато-жовтим світлом. У чистому вигляді дуже отруйний, при нагріванні перетворюється на червоний. Використовується для утворення фосфатних кислот та димових завіс.
Червоний фосфор – порошок від темно-коричневого до червоного кольору, у темряві не світиться, не отруйний. Використовується в металургії та для знищення шкідників.
Чорний фосфор – речовина схожа на графіт, має кристалічний блиск, не отруйний.
 
Червоний фосфор Білий фосфор з жовтим відтінком на зрізі під шаром води
3. Хімічний властивості
1. Взаємодіє з металами
3Mg+2P Mg3P2 Mg3P2
2. Взаємодіє з неметалами (з воднем майже не взаємодіє, а з Оксигеном утворює оксид фосфору V)
4P+5O2 2P2O5 2P2O5
4.Оксиди фосфору
З оксидів фосфору Р2О5 і Р2О3 найбільше значення має оксид фосфору (V).
Р2О5 – білий, дрібнокристалічний порошок; кислотний оксид, який при взаємодії з водою утворює фосфатні кислоти:
Р2О5+Н2О 2НРО3 2НРО3
Р2О5+3Н2О 2Н3,РО4 2Н3,РО4
5.Фосфати
Фосфати – солі фосфатної кислоти. Н3РО4 утворює ряд солей:
а) середні;
б) кислі;
в) дуже кислі.
Найважливіші фосфатні добрива: подвійний суперфосфат, простий суперфосфат, фосфатні добрива і преципітат.
|  Головна
Головна  Каталог файлів
Каталог файлів  Реєстрація
Реєстрація  Вхід
Вхід