Розділ І. Неорганічна хімія
Лекція
Тема: Періодична система та періодичний закон Д.І. Менделєєва.
Хімічний зв'язок та будова атома.
- Періодична система Д.І. Менделєєва
- Будова атома хімічного елемента
- Сполучення атомів
- Характеристика хімічного елемента в періодичній системі
- Періодична система Д.І. Менделєєва
 
Вчені за часів Дмитра Івановича Менделєєва намагалися класифікувати всі хімічні елементи та поділити їх на родини. На той час було відомо 6 груп хімічних елементів подібних за властивостями: лужні та лужноземельні метали, Галогени, групи Оксигену, Нітрогену та Карбону. Але згрупувати відомі на той час 63 хімічних елементів не вдавалося. Спираючись на праці своїх попередників це завдання розв’язав Менделєєв, який вважав, що між усіма елементами , як подібними за властивостями так і відмінними, існує природній зв'язок, що об’єднує всі хімічні елементи в єдину систему.
За основу систематизації він обрав відносну атомну масу, вважаючи її основною характеристикою хімічного елемента так, як вона не змінюється при утворенні простих і складних сполук. Крім того, Менделєєв розглядав не лише відносну атомну масу як єдину характеристику, а й враховував хімічні властивості.
Суть періодичного закону: властивості елементів залежать від величини відносної атомної маси.
Періодична система відкрита у 1869 році та складається з періодів та груп.
Період – горизонтальний ряд хімічних елементів розміщених у порядку зростання їх відносних атомних мас, який починається лужним металом та закінчується інертним газом.
Типи періодів:
- малий період – період, який складається з одного ряду хімічних елементів;
- великий період - період, який складається з двох рядів хімічних елементів.
Усього періодів сім. Із них перші три — малі періоди, бо кожний складається з одного ряду хімічних елементів. Починаючи з четвертого, ідуть великі періоди (кожний складається з двох рядів). Усього рядів десять. Кожний період містить певне число хімічних елементів:
1- й період (малий) — 2 елементи;
2- й період (малий) — 8 елементів;
3- й період (малий) — 8 елементів;
4- й період (великий) — 18 елементів;
5- й період (великий) — 18 елементів;
6- й період (великий) — 32 елементи;
7- й період (великий) — досі ще не завершений, містить поки що 24 елементи.
Група – вертикальний ряд хімічних елементів в якому один під одним розміщені подібні за властивостями хімічні елементи.
Група має головну та побічну підгрупи.
Закономірності періодичної системи:
- валентність хімічного елемента відповідає номеру групи хімічного елемента;
- якщо провести умовну лінію від Бору до Астату, то нижче цієї лінії будуть метали, а вище – у головних підгрупах неметали, а у побічних підгрупах метали;
- у малих періодах зі збільшенням відносної атомної маси зменшуються металічні властивості;
- у групах металічні властивості збільшуються зі збільшенням відносної атомної маси.
2. Будова атома хімічного елемента
Всі хімічні елементи побудовані з атомів, які складаються з позитивно зарядженого ядра і негативно заряджених електронів. Саме ж ядро складається з протонів з позитивним зарядом та нейтронів з нейтральним зарядом. Кількість протонів у ядрі відповідає кількості електронів. Кількість нейтронів можна визначити віднявши від відносної атомної маси елемента кількість протонів чи електронів.

Атом має електронні шари, які називаються енергетичними рівнями та по яких рухаються електрони. Кількість енергетичних рівнів відповідає номеру періоду в якому знаходиться хімічний елемент, тобто всього 7 енергетичних рівнів.
Максимальне число електронів – 2, 8, 18, 32. Енергетичні рівні діляться на підрівні, які позначаються літерами – s, p, d, f.
На s – підрівні максимальна кількість електронів - 2, на p – 6 електронів, на d – 10 електронів, на f – 14 електронів.
Число електронів на останньому підрівні відповідає номеру групи в періодичній таблиці. Ці електрони називаються зовнішніми або валентними так, як утворюють хімічні зв’язки з іншими атомами.
3. Сполучення атомів
Неспарені зовнішні електрони мають найбільше енергії та найбільш рухливі, тому взаємодіють із зовнішніми електронами інших атомів утворюючи хімічні зв’язки.
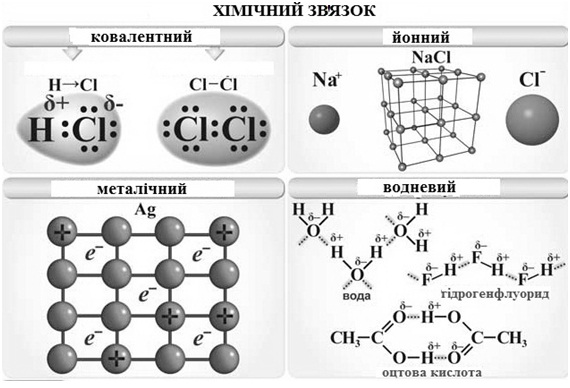
Типи зв’язків:
- ковалентний :
- неполярний – утворюється між атомами одного і того ж хімічного елемента (Н2, О2);
- полярний – утворюється в молекулах утворених атомами різних хімічних елементів (Н2О).
- іонний – утворюється в молекулах об’єднаних не атомами, а іонами (К+, Н+)
- металічний – утворюється в металах забезпечуючи добре проводження електричного струму та тепла
- водневий – утворюється між молекулами води.
4. Характеристика хімічного елемента:
- символ хімічного елемента та його назва;
- положення хімічного елемента в періодичній системі (порядковий номер, номер періоду, групи, підгрупи);
- будова атома хімічного елемента (відносна атомна маса, число протонів, електронів та нейтронів, число енергетичних рівнів);
- електронна та електронно – графічна формула атома, його валентні електрони.
|  Головна
Головна  Каталог файлів
Каталог файлів  Реєстрація
Реєстрація  Вхід
Вхід