Лекція
Тема: Основні класи неорганічних сполук
- Оксиди
- Кислоти
- Основи
- Солі
1. Оксиди
Неорганічні речовини – хімічні сполуки, які не містять атомів карбону пов’язаних з атомами гідрогену.
Вони поділяються на:
- прості – речовина, молекула яких складається з атомів одного виду (Н2, О2);
- складні – речовина, молекула яких складається з атомів різних видів (Н2О).
Оксиди – складні речовини утворені атомами двох елементів, одним з яких обов’язково є Оксиген.
Їх назва складається із слова «оксид» з додаванням спочатку назви елемента, який входить до складу речовини у називному відмінку (СuО - купрум оксид).
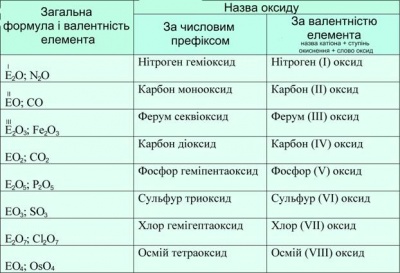
Класифікація оксидів:
- основні – оксиди, яким відповідають основи та утворюються металами (СиО, СаО);
- кислотні - оксиди, яким відповідають кислоти та утворюються неметалами (Р2О5, СО2);
- амфотерні – оксиди, які мають властивості основ та кислот, утворені металами і неметалами.
Поширення оксидів у природі:
- SiO2 – є складовою піску, глини, мінералів:
- СО2 – вуглекислий газ;
- Al2O3 – входить до складу глини і мінералів;
- Fe2O3 – знаходиться в залізних рудах;
- Н2О – вода.
Властивості оксидів на прикладі Н2О
Фізичні властивості: прозора без смаку і запаху рідина, добрий розчинник, проводить електрику, має три агрегатних стани (рідкий, твердий, газоподібний).
Хімічні властивості:
а) метали у ряді напруг до Алюмінію реагують за звичайних умов з виділенням водню:
2 Na + 2 Н2О = 2NaOH + H2
б) метали у ряді напруг після Гідрогену з водою не реагують;
в) метали від Мангану до Гідрогену у ряді напруг реагують при нагріванні:
2Fe + 3 H2O = Fe2O3 + 3 H2
СаО + H2O = Са(ОН)2
- з оксидами неметалів утворюючи розчинні кислоти:
СО2 + H2O = Н2СО3
- вода розкладається під дією високих температур та електричного струму
2 Н2О = 2 H2 + О2
2. Кислоти
Кислоти – складні речовини, які складаються з одного чи декількох атомів Гідрогену та кислотного залишку.
 
Кислоти класифікуються на :
1) за кількістю атомів Гідрогену в кислоті на:
- одноосновні (HCl, HNO3)
- двохосновні (H2S, H2SO4)
- трьохосновні (H3PO4)
2) за наявністю Оксигену в кислотному залишку на:
- безоксигенові (HCl)
- оксигенові (H3PO4)
Оксигенові кислоти:
H2SO4 – сульфатна кислота;
H2SO3 – сульфітна кислота;
HNO3 - нітратна кислота;
H3PO4 – ортофосфатна кислота;
HPO3 – метафосфатна кислота;
H2CO3 – карбонатна кислота;
H2SіO3 – силікатна кислота.
Безоксигенові кислоти:
HCl – хлоридна (соляна) кислота;
HF – фтороводнева кислота;
HBr - бромоводнева кислота;
HI - йодоводнева кислота;
H2S – сульфідна кислота;
Одержання кислот:
- оксиди при взаємодії з водою утворюють оксигенові кислоти:
SO2 + H2 О = H2SO3
- метали при взаємодії з воднем утворюють безоксигенові кислоти:
H2 + Cl2 = 2 HCl
Властивості кислот
Фізичні: більшість рідини, але існують і тверді речовини; важчі за воду; добре розчинні у воді; деякі кислоти леткі (HCl, HNO3); мають характерний запах; майже всі безбарвні.
Хімічні:
- діють на індикатори – речовини, які змінюють своє забарвлення під дією кислот чи лугів (лакмусовий папірець набуває червоного кольору);
- взаємодіють з металами
Метали у ряді напруг до Гідрогену, витісняють його з кислот (крім HNO3 )
Zn + 2 HCl = ZnCl2 + H2
- кислоти реагують з оксидами, які утворені металами
СиО + 2 HCl = СиCl2 + H2О
реакція обміну – реакція між двома складними речовинами в результаті яких вони обмінюються складовими частинами.
- взаємодіють з основами:
NaOH + HCl = NaCl + H2О
3. Основи
Основи – складні речовини до складу яких входить атом металу і одна або кілька гідроксильних груп.
Назва утворюється від назви відповідного металу в називному відмінку з додаванням слова «гідроксид» (Са(ОН)2 – кальцій (ІІ) гідроксид, гашене вапно).

Класифікація за розчинністю у воді:
- розчинні (луги) – добуті лужними і лужноземельними металами;
- не розчинні – всі інші основи.
Властивості:
1) фізичні: луги – тверді білого кольору розчинні речовини, милкі, їдкі, а нерозчинні речовини – тверді і різного кольору.
2) хімічні:
Луги діють на індикатор змінюючи колір (фенолфталеїн безбарвний, але при змішуванні з лугами дає малинове забарвлення; метил оранжевий – жовте забарвлення, лакмусовий папірець – синіє).
Нерозчинні основи: не змінюють забарвлення індикаторів; не взаємодіють з кислотними оксидами, розкладаються при нагріванні
Си(ОН)2 → СиО + H2О
Добування основ:
- розчинні луги добувають змішуванням води з лужними чи лужноземельними металами, або ж до оксидів лужних чи лужноземельних металів додають воду
2К + 2 H2О = 2 КОН + H2
ВаОН + H2О = Ва(ОН)2
- нерозчинні луги добувають з розчинних солей з лугами
FeCl3 + 3 NаОН = 3 NаCl + Fe(ОН)3
4. Солі
Солі – складні речовини, утворені атомами металів і кислотними залишками.
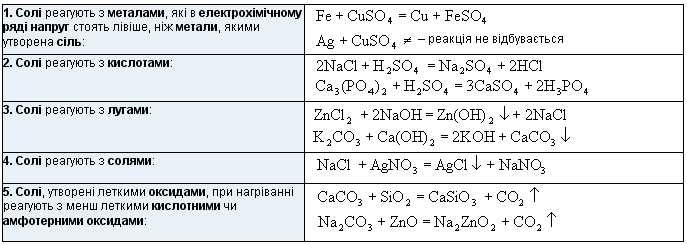
Назви солей, які утворені кислотами:
H2 SO4 – сульфати
H2 SO3 – сульфіти
HNO3 - нітрати
H2CO3 – карбонати
H3PO4 – фосфати
Фізичні властивості: Тверді кристали різного кольору, розчинні у воді.
|  Головна
Головна  Каталог файлів
Каталог файлів  Реєстрація
Реєстрація  Вхід
Вхід