Тема: Дисоціація та окисно - відновні реакції
1. Теорія електролітичної дисоціації
2. Окисно-відновні реакції
1. Теорія електролітичної дисоціації
Електролітична дисоціація – це процес розщеплення електролітів на іони у водних розчинах та сплавах.
Речовини, які не проводять електричний струм називаються неелектролітами. Теорія електролітичної дисоціації була відкрита у 1887 році.
 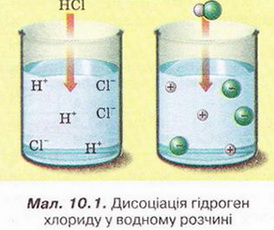
Її основні положення:
- при розщепленні електроліту відбувається дисоціація на позитивно заряджений іони (аніони) та негативно заряджені іони (катіони);
- дисоціація - оборотній процес, який не відбувається до кінця ,тому у рівнянні ставиться не знак « = », а « »; »;
- іони перебувають в хаотичному русі , катіони притягуються до аніонів.
Рівняння дисоціації сульфатної кислоти:
H2 SO4 ↔H+ + HSO4-
HSO4- ↔ H+ + SO42 –
H2 SO4 ↔2H+ + SO42-
Рівняння дисоціації ортофосфатної кислоти:
H3PO4 ↔ H+ + H2PO4 -
H2PO4 - ↔ H+ + HPO4 2 –
HPO4 2 – ↔ H+ + PO4 3 –
H3PO4 ↔ 3H+ + PO4 3-
Рівняння дисоціації гідроксиду барію (основи):
+ +Ba(OH)2 ↔ BaOHOH–
+ 2+ BaOH ↔ BaOH–
Ba(OH)2 ↔ Ba2+ + 2OH–
2. Окисно-відновні реакції
Окисно-відновні реакції – це реакції, внаслідок яких атоми змінюють свої ступені окиснення до реакції і після реакції.
Атоми, які віддають електроліти називаються відновниками. Атоми, які приймають електроліти - окисниками. Процес віддачі електролітів називається окисленням, а процес прийняття електронів – відновленням.

|  Головна
Головна  Каталог файлів
Каталог файлів  Реєстрація
Реєстрація  Вхід
Вхід